كسر القواعد – اكتشاف مسار جزيئي مهم للسيطرة على الشيخوخة

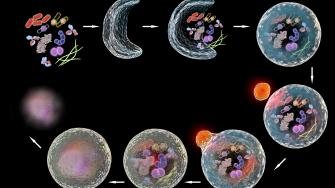
أظهرت الأبحاث التي أجريت على أنواع الدودة المستديرة C. elegans أن الاضطرابات في نقل الحمض النووي الريبي (RNA) بين الخلايا عبر الأنسجة المختلفة يمكن أن تؤدي إلى تقصير العمر.
تتفاعل الخلايا في الأنسجة المختلفة من خلال مشاركة جزيئات الحمض النووي الريبي (RNA) .
اكتشفت دراسة أجراها علماء من جامعة ولاية كامبيناس (UNICAMP) في البرازيل، باستخدام أنواع الدودة المستديرة Caenorhabditis elegans، أن الاضطرابات في طريقة الاتصال هذه يمكن أن تؤدي إلى انخفاض عمر الكائن الحي. وقد نشرت الدراسة مؤخرا في مجلة جين . وتساهم النتائج في فهم أفضل لعملية الشيخوخة والأمراض المرتبطة بها.
“أظهرت الأبحاث السابقة أن بعض أنواع الحمض النووي الريبوزي (RNA) يمكن نقلها من خلية إلى أخرى، من خلال التواصل بين الأنسجة، من النوع الذي يحدث مع البروتينات والمستقلبات، على سبيل المثال. وتعتبر هذه آلية للإشارة بين الأعضاء أو الخلايا المجاورة. قال مارسيلو موري، المؤلف المقابل للمقالة والأستاذ في معهد علم الأحياء (IB-UNICAMP): ” إنها جزء من [علم وظائف الأعضاء ] للعديد من الأمراض ومن الأداء الطبيعي للكائن الحي”. “ما لم يكن واضحا ونجحنا الآن في إثباته هو أن التغيرات في نمط هذا “المحادثة” بين جزيئات الحمض النووي الريبي (RNA) يمكن أن تؤثر على الشيخوخة”.
أجريت الدراسة في مركز أبحاث السمنة والأمراض المصاحبة (OCRC) التابع لـ UNICAMP، وهو أحد مراكز البحث والابتكار والنشر (RIDCs) الممولة من FAPESP. وتم تمويله أيضًا من خلال مشروع يعد موري الباحث الرئيسي فيه.
“يجب أن يتم تعديل آلية الاتصال هذه بشكل جيد لمنح الكائن الحي عمرًا مناسبًا. وقال موري: “في الدراسة، وجدنا أنه إذا زاد أي نسيج من قدرته على امتصاص بعض أنواع الحمض النووي الريبي (RNA) من الوسط خارج الخلية، فإن هذا ينتهي به الأمر إلى التأثير على عمر الكائن الحي”.
وأضاف أن الباحثين أثبتوا أن انخفاض العمر لا يرجع فقط إلى انقطاع الاتصال القائم على الحمض النووي الريبوزي (RNA) بين الأنسجة في نفس الكائن الحي، ولكن أيضًا إلى زيادة القدرة على امتصاص الحمض النووي الريبي (RNA) من البيئة – البكتيريا الموجودة في الكائنات الحية الدقيقة، مثال. كما يشرحون في المقال، “تدعم بياناتنا فكرة أن إشارات الحمض النووي الريبي (RNA) النظامية يجب أن تكون منظمة بإحكام، وعدم توازن هذه العملية يؤدي إلى انخفاض في العمر الافتراضي. لقد أطلقنا على هذه الظاهرة اسم خلل الحمض النووي الريبوزي النظامي بين الخلايا/خارج الخلية (InExS)”.
كسر القواعد
وأوضح موري أن قرار البحث في آلية نقل الحمض النووي الريبوزي (RNA) بين الخلايا كان مستوحى من اكتشاف تداخل الحمض النووي الريبي (RNA)، والذي فاز عنه العالمان الأمريكيان أندرو فاير وكريج ميلو بجائزة نوبل في علم وظائف الأعضاء والطب لعام 2006. لقد قاموا بحقن الحمض النووي الريبوزي المزدوج في C. elegans من أجل “إسكات” الجينات بدقة كبيرة. وقال: “لقد وجدوا أن آلية الإسكات أثرت على الجينات الموجودة في الأنسجة الأخرى وكذلك الأنسجة المعنية، وأنها انتقلت إلى الأجيال التالية”.
أوضح اكتشاف تداخل الحمض النووي الريبوزي (RNA) الآليات الكامنة وراء نقل الحمض النووي الريبي (RNA) بين الخلايا في الكائن الحي وبين الكائن الحي والبيئة. كما أنها نسبت عقيدة مركزية للبيولوجيا الجزيئية. حتى ذلك الحين، كان يُعتقد أن المعلومات التي تجسدها الشفرة الوراثية تتدفق فقط من الحمض النووي إلى الحمض النووي الريبي (RNA)، ومن هناك إلى البروتينات، لكن عمل فاير وكريج كشف أن الحمض النووي الريبي المزدوج يمكن أن يمنع هذا التدفق. يتم تدمير Messenger RNA عن طريق تداخل RNA، الذي يُسكت جينات معينة دون تغيير تسلسل الحمض النووي، مما يُظهر أن RNA يمكنه أيضًا أداء وظيفة تنظيمية في الجينوم. على الرغم من أن الجينوم البشري يضم حوالي 30.000 جين، إلا أنه يتم استخدام عدد قليل فقط في كل خلية لتخليق البروتينات. تلعب نسبة كبيرة منها دورًا تنظيميًا، حيث تؤثر على التعبير عن الجينات الأخرى.
التوازن هو كل شيء
“أردنا أن نفهم كيف يمكن أن تتداخل هذه العملية مع الوظائف الفسيولوجية الهامة المرتبطة بالشيخوخة. في C. elegans ، يتضمن نقل الحمض النووي الريبي (RNA) بين الخلايا ما يعرف بالجينات المعيبة لتداخل الحمض النووي الريبي (SID) [ المسؤولة عن المراحل المختلفة في امتصاص الحمض النووي الريبي (RNA) وتصديره ). لاحظنا أن نمط التعبير الجيني المرتبط بهذا المسار في أنسجة معينة تغير أثناء الشيخوخة. وقال موري : “إن الحمض النووي الريبي المرسال الذي يشفر البروتين SID-1 [ أساسي للامتصاص الخلوي للحمض النووي الريبي ]، على سبيل المثال، زاد في بعض الأنسجة وانخفض في أنسجة أخرى”.
لمعرفة المزيد عن دور الحمض النووي الريبوزي (RNA) في إشارات الأنسجة، أجرى الباحثون تجارب تلاعبوا فيها بالتعبير عن البروتين SID-1 في أنسجة معينة من C. elegans ، مثل الخلايا العصبية والأمعاء والعضلات، من أجل تغيير وظيفتها.
“لقد وجدنا أن الطفرات التي لا تحتوي على وظيفة SID-1 تتمتع بصحة جيدة مثل الديدان البرية، في حين أن الإفراط في التعبير عن SID-1 في الأمعاء أو العضلات أو الخلايا العصبية يقلل من عمر الديدان المعنية. ووجدنا أيضًا أن انخفاض العمر يرتبط بالإفراط في التعبير عن البروتينات الأخرى في مسار نقل الحمض النووي الريبوزي، مثل SID-2 وSID-5.
قد يكمن خلل التنظيم في توزيع الحمض النووي الريبي (RNA) على الأنسجة. وقال : “لإلغاء تنظيم توزيع الحمض النووي الريبي (RNA) في الديدان، قمنا بزيادة تعبير SID-1 في أنسجة معينة ( الأمعاء والعضلات والخلايا العصبية ) ووجدنا أن توجيهه إلى عضو معين أدى إلى انخفاض العمر”.
“لقد أظهرنا أيضًا أن هذا الخلل في نقل الحمض النووي الريبي (RNA) أدى إلى فقدان الوظيفة في المسار الذي ينتج microRNAs [ قطع صغيرة من الحمض النووي الريبي (RNA) غير المشفر مع وظيفة تنظيمية ]. يبدو الأمر كما لو أن العدد الأكبر من RNAs المنقولة إلى هذه الأنسجة خلق نوعًا من المنافسة التي كان فيها إنتاج microRNAs هو الخاسر. وقد أظهرت الأبحاث السابقة بالفعل أن فقدان الوظيفة في إنتاج microRNA أدى إلى انخفاض العمر.
قامت مجموعة UNICAMP أيضًا بالتحقيق في نقل الحمض النووي الريبي (RNA) خارجي المنشأ (بين البيئة الخارجية والكائن الحي). كما هو الحال في التجارب السابقة، يرتبط انخفاض العمر بالإفراط في التعبير عن SID-2، الذي يتوسط امتصاص الحمض النووي الريبوزي (RNA) من الأمعاء، ومع الإفراط في إنتاج الحمض النووي الريبي (RNA) بواسطة البكتيريا التي تتغذى عليها الديدان والتي ينتهي بها الأمر في الكائنات الحية الدقيقة في الأمعاء.
وقال موري: “نعتقد أن الديدان قد تستخدم الحمض النووي الريبوزي خارجي المنشأ لمراقبة الكائنات الحية الدقيقة في البيئة، ولكن قد تحدث آثار سلبية عندما تمتص أنسجتها كميات زائدة”. “عندما أجبرنا البكتيريا في المختبر على التعبير عن المزيد من الحمض النووي الريبي المزدوج الجديلة، انخفض عمر الديدان. ويتداخل نقل الحمض النووي الريبوزي (RNA) الزائد مع التوازن وإنتاج الحمض النووي الريبي (RNA) الداخلي، مما يسرع عملية الشيخوخة.